

: 実験目的
: 超伝導と遷移金属酸化物
: 従来の酸化物超伝導体
図 9:
酸化物超伝導体発見後の臨界温度
| r0.45
|
1986年,IBMチューリッヒ研究所のべドノルツ(Bednorz)とミュラー(Müller)はZeitschrift für Physik B2という論文誌に,遷移金属酸化物La Ba
Ba Cu
Cu O系の電気抵抗が30 [K]近傍から急激に減少することを報告した.その数か月後,ヒューストン大学のチユ−(Chu)らは,LaをYで置換したY
O系の電気抵抗が30 [K]近傍から急激に減少することを報告した.その数か月後,ヒューストン大学のチユ−(Chu)らは,LaをYで置換したY Ba
Ba Cu
Cu O系酸化物の
O系酸化物の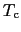 が液体窒素沸点77 [K]を超えることを発見した.77 [K]以上の
が液体窒素沸点77 [K]を超えることを発見した.77 [K]以上の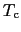 を持つ超伝導体を使えば,電子デバイスや各種の電力用機器がそれまでの液体ヘリウムよりも安価で扱いやすい液体窒素によって使用可能となる.これによって酸化物超伝導体は一躍脚光を浴びることとなった.Y
を持つ超伝導体を使えば,電子デバイスや各種の電力用機器がそれまでの液体ヘリウムよりも安価で扱いやすい液体窒素によって使用可能となる.これによって酸化物超伝導体は一躍脚光を浴びることとなった.Y Ba
Ba Cu
Cu O系酸化物は当初幾つかの化合物からなる混合相であったが,その後YBa
O系酸化物は当初幾つかの化合物からなる混合相であったが,その後YBa Cu
Cu O
O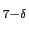 (
(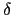 は酸素欠損量を表す)が超伝導物質であり,その
は酸素欠損量を表す)が超伝導物質であり,その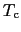 は90 [K]であることが明らかになった.層状ペロブスカイト構造を基本とする酸化物超伝導体はその後も続々と発見されるとともに,
は90 [K]であることが明らかになった.層状ペロブスカイト構造を基本とする酸化物超伝導体はその後も続々と発見されるとともに,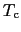 の値は更新を続け,Bi
の値は更新を続け,Bi Sr
Sr Ca
Ca Cu
Cu O系(
O系(
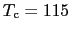 [K]),Tl
[K]),Tl Sr
Sr Ca
Ca Cu
Cu O系(
O系(
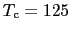 [K]),Hg
[K]),Hg Ba
Ba Ca
Ca Cu
Cu O系(圧力下
O系(圧力下
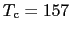 [K])などが発見された.代表的高温超伝導体YBa
[K])などが発見された.代表的高温超伝導体YBa Cu
Cu O
O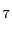 の結晶構造を図10(a)に,その酸素欠損型絶縁体YBa
の結晶構造を図10(a)に,その酸素欠損型絶縁体YBa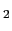 Cu
Cu O
O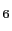 の構造を図10(b)に示す.ある結晶位置における酸素の有無により,一方は超伝導体であり他方は絶縁体である.
の構造を図10(b)に示す.ある結晶位置における酸素の有無により,一方は超伝導体であり他方は絶縁体である.
酸化物のなかには.6個の酸素原子のつくる八面体を基本ブロックとし,その八面体の稜または頂点を共有して,ある一定の方向に規則的に連結されてできる一連の系列が数多く知られている.図10に示したYBa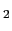 Cu
Cu O
O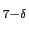 もこのようなある大きな系列のメンバーと考えることができる.酸素濃度の減少(
もこのようなある大きな系列のメンバーと考えることができる.酸素濃度の減少(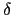 の増加)に伴い,Y
の増加)に伴い,Y Ba
Ba Cu
Cu O系の結晶系は直方晶から正方晶へ変化する.ぺロブスカイト関連化合物を例に挙げて,酸化物でかなり一般的にみられる結晶構造の規則性について紹介しよう.
O系の結晶系は直方晶から正方晶へ変化する.ぺロブスカイト関連化合物を例に挙げて,酸化物でかなり一般的にみられる結晶構造の規則性について紹介しよう.
図 11:
M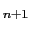 T
T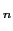 O
O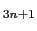 型ペロブスカイト系列の構造模式図(黒丸はM原子,正方形は中心にT原子を含む酸素の八面体の投影図)
型ペロブスカイト系列の構造模式図(黒丸はM原子,正方形は中心にT原子を含む酸素の八面体の投影図)
|
|
図 12:
M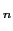 T
T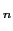 O
O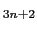 型ペロブスカイト系列の構造模式図
型ペロブスカイト系列の構造模式図
|
|
図11の正方形は上で述べたような八面体を見下ろしたもので,T原子(黒丸)は各々の八面体の中心を占める.右端のペロブスカイトMTO の頂点で連結している所で水平に(紙面に垂直に)ナイフを入れて切り離し,格子定数の半分だけずらしながら積み上げてゆくと,左端に示すM
の頂点で連結している所で水平に(紙面に垂直に)ナイフを入れて切り離し,格子定数の半分だけずらしながら積み上げてゆくと,左端に示すM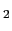 TO
TO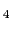 となり,これがK
となり,これがK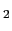 NiF
NiF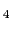 型構造である.2層ごとに切り離して同様にかさねてゆくとM
型構造である.2層ごとに切り離して同様にかさねてゆくとM T
T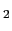 O
O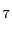 となり,これもSr
となり,これもSr Ti
Ti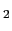 O
O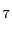 などとして確認されている実在の構造である.この繰作を繰り返してゆくと原理的には無限に新しい構造が考えられ,一般にM
などとして確認されている実在の構造である.この繰作を繰り返してゆくと原理的には無限に新しい構造が考えられ,一般にM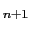 T
T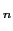 O
O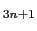 = (MO)(MTO
= (MO)(MTO )
)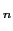 で表すことができる.ここで,
で表すことができる.ここで,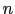 は八面体のつくる面の枚数を表し,K
は八面体のつくる面の枚数を表し,K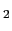 NiF
NiF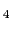 型は
型は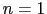 ,M
,M T
T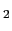 O
O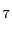 型は
型は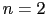 となり,ペロブスカイトMTO
となり,ペロブスカイトMTO は
は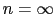 に対応する.
に対応する.
次に,ペロブスカイトに入れた先ほどのカット面より45 [deg]だけずらした八面体の稜に平行にカットを入れると,どのような構造が得られるかを示したのが図12である.この場合はM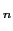 T
T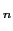 O
O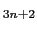 で表せる系列が得られ,同様に,
で表せる系列が得られ,同様に,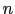 は八面体層の層数を表している.実際には,八面体が紙面に垂直な軸のまわりに少しねじれた構造となるが,たとえば
は八面体層の層数を表している.実際には,八面体が紙面に垂直な軸のまわりに少しねじれた構造となるが,たとえば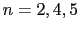 などは実在することが確認されている.このようなモデル化を基本にして新しい構造の酸化物を探索してゆくこともできる.
などは実在することが確認されている.このようなモデル化を基本にして新しい構造の酸化物を探索してゆくこともできる.
図 13:
(a) ペロブスカイト型MTO と(b) 酸素欠損型ペロブスカイトM
と(b) 酸素欠損型ペロブスカイトM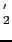 MT
MT O
O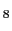 ((a)の灰色の酸素が抜けて(b)の構造となり,さらに(b)の灰色の酸素が抜けるとYBa
((a)の灰色の酸素が抜けて(b)の構造となり,さらに(b)の灰色の酸素が抜けるとYBa Cu
Cu O
O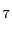 型となる.)
型となる.)
|
|
さて図10(a)に示したYBa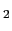 Cu
Cu O
O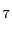 の結晶構造がペロブスカイト構造とどのような関係にあるかを説明しよう.図13(a)のペロブスカイトMTO
の結晶構造がペロブスカイト構造とどのような関係にあるかを説明しよう.図13(a)のペロブスカイトMTO から,まず中間層の4個の酸素(灰色の円)を抜き取り,その同じ面内のM原子だけを残して上下4個のM原子をM
から,まず中間層の4個の酸素(灰色の円)を抜き取り,その同じ面内のM原子だけを残して上下4個のM原子をM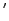 原子で置き換えると(b)のようなM
原子で置き換えると(b)のようなM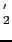 MT
MT O
O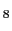 が得られる.この構造からさらに底面の酸素のうち半分だけ(灰色の円)抜き取ると,M
が得られる.この構造からさらに底面の酸素のうち半分だけ(灰色の円)抜き取ると,M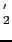 MT
MT O
O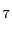 となり,M
となり,M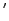 = Ba,M = Y,T = Cuと考えると図10(a)のYBa
= Ba,M = Y,T = Cuと考えると図10(a)のYBa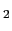 Cu
Cu O
O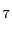 となる.つまり,この90 [K]級の酸化物超伝導体は,Ba
となる.つまり,この90 [K]級の酸化物超伝導体は,Ba Ba
Ba Y
Y Ba
Ba BaというM原子の秩序をもつ酸素欠損型ペロブスカイトと考えることもできる.
BaというM原子の秩序をもつ酸素欠損型ペロブスカイトと考えることもできる.
図 14:
YBa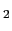 Cu
Cu O
O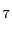 の
の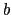 軸方向から見た(a) 原子配置と(b)
軸方向から見た(a) 原子配置と(b) 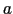 軸方向から見た原子配置(細線の円はそれぞれ
軸方向から見た原子配置(細線の円はそれぞれ
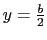 ,
,
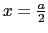 にある原子を示している)
にある原子を示している)
|
|
図14(a)は各格子の位置およびイオン半径を格子定数に比例して描いた図で,細線の円は
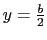 ,すなわち紙面に垂直方向に半単位長ずれた位置にある原子を表している.この構造は
,すなわち紙面に垂直方向に半単位長ずれた位置にある原子を表している.この構造は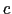 軸方向にBa
軸方向にBa Y
Y Baという3層構造となっているので,図中の破線に村応する
Baという3層構造となっているので,図中の破線に村応する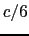 の整数倍の位置が各原子の理想的な位置となる.ところが,ほとんどすべての原子がこの理想的な位置からずれていることがわかる.そして,そのずれはイットリウムのまわりの酸素とバリウムで特に大きいことに気づく.これはイットリウムがまわりの酸素と強く結合していることを示している.
の整数倍の位置が各原子の理想的な位置となる.ところが,ほとんどすべての原子がこの理想的な位置からずれていることがわかる.そして,そのずれはイットリウムのまわりの酸素とバリウムで特に大きいことに気づく.これはイットリウムがまわりの酸素と強く結合していることを示している.
そこで,イットリウムをはさむ上下の面のところに仮にYCuO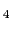 という化合物層ができていると考えてみよう.YBa
という化合物層ができていると考えてみよう.YBa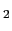 Cu
Cu O
O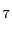 は底面上のCu1
は底面上のCu1 O1とO4の層(これを仮にCuO
O1とO4の層(これを仮にCuO と呼ぶ)が図14(b)に示すようにYCuO
と呼ぶ)が図14(b)に示すようにYCuO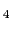 層によって上下をはさまれたような構造をしていると考えられる.図から明らかなように,そのCuO
層によって上下をはさまれたような構造をしていると考えられる.図から明らかなように,そのCuO 層は
層は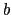 軸方向に銅と酸素が交互に連なった1次元的な鎖から成り立ち,その鎖に平行してCuO
軸方向に銅と酸素が交互に連なった1次元的な鎖から成り立ち,その鎖に平行してCuO 層とバリウムに囲まれた大きな空洞が存在する.しかもバリウム原子はYCuO
層とバリウムに囲まれた大きな空洞が存在する.しかもバリウム原子はYCuO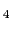 層の方向にかなり引き寄せられているため,この空洞はさらに大きくなっていることに注目しよう.このバリウムのずれは一見意外に思えるが,YCuO
層の方向にかなり引き寄せられているため,この空洞はさらに大きくなっていることに注目しよう.このバリウムのずれは一見意外に思えるが,YCuO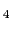 層の価数の釣合いを考えてみれば説明がつきそうである.つまり,2価のバリウム陽イオンがこのようにずれることによってYCuO
層の価数の釣合いを考えてみれば説明がつきそうである.つまり,2価のバリウム陽イオンがこのようにずれることによってYCuO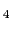 層の陽価数の不足分を補っていると考えればよい.したがって,このYCuO
層の陽価数の不足分を補っていると考えればよい.したがって,このYCuO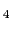 層は電気的にほぼ中和した,結合力の強い安定な2次元的な層となっており,空洞のまわりのCuO
層は電気的にほぼ中和した,結合力の強い安定な2次元的な層となっており,空洞のまわりのCuO 層とは対照的である.このような構造的な特徴は,化学的な安定性や物理的性質に反映されているはずである.
層とは対照的である.このような構造的な特徴は,化学的な安定性や物理的性質に反映されているはずである.
Masashige Onoda
平成18年4月11日
![\includegraphics[width=0.4\textwidth, clip]{fig12.eps}](img59.png)
![]() Cu
Cu![]() O
O![]() もこのようなある大きな系列のメンバーと考えることができる.酸素濃度の減少(
もこのようなある大きな系列のメンバーと考えることができる.酸素濃度の減少(![]() の増加)に伴い,Y
の増加)に伴い,Y![]() Ba
Ba![]() Cu
Cu![]() O系の結晶系は直方晶から正方晶へ変化する.ぺロブスカイト関連化合物を例に挙げて,酸化物でかなり一般的にみられる結晶構造の規則性について紹介しよう.
O系の結晶系は直方晶から正方晶へ変化する.ぺロブスカイト関連化合物を例に挙げて,酸化物でかなり一般的にみられる結晶構造の規則性について紹介しよう.
![]() T
T![]() O
O![]() で表せる系列が得られ,同様に,
で表せる系列が得られ,同様に,![]() は八面体層の層数を表している.実際には,八面体が紙面に垂直な軸のまわりに少しねじれた構造となるが,たとえば
は八面体層の層数を表している.実際には,八面体が紙面に垂直な軸のまわりに少しねじれた構造となるが,たとえば![]() などは実在することが確認されている.このようなモデル化を基本にして新しい構造の酸化物を探索してゆくこともできる.
などは実在することが確認されている.このようなモデル化を基本にして新しい構造の酸化物を探索してゆくこともできる.
![]() という化合物層ができていると考えてみよう.YBa
という化合物層ができていると考えてみよう.YBa![]() Cu
Cu![]() O
O![]() は底面上のCu1
は底面上のCu1![]() O1とO4の層(これを仮にCuO
O1とO4の層(これを仮にCuO![]() と呼ぶ)が図14(b)に示すようにYCuO
と呼ぶ)が図14(b)に示すようにYCuO![]() 層によって上下をはさまれたような構造をしていると考えられる.図から明らかなように,そのCuO
層によって上下をはさまれたような構造をしていると考えられる.図から明らかなように,そのCuO![]() 層は
層は![]() 軸方向に銅と酸素が交互に連なった1次元的な鎖から成り立ち,その鎖に平行してCuO
軸方向に銅と酸素が交互に連なった1次元的な鎖から成り立ち,その鎖に平行してCuO![]() 層とバリウムに囲まれた大きな空洞が存在する.しかもバリウム原子はYCuO
層とバリウムに囲まれた大きな空洞が存在する.しかもバリウム原子はYCuO![]() 層の方向にかなり引き寄せられているため,この空洞はさらに大きくなっていることに注目しよう.このバリウムのずれは一見意外に思えるが,YCuO
層の方向にかなり引き寄せられているため,この空洞はさらに大きくなっていることに注目しよう.このバリウムのずれは一見意外に思えるが,YCuO![]() 層の価数の釣合いを考えてみれば説明がつきそうである.つまり,2価のバリウム陽イオンがこのようにずれることによってYCuO
層の価数の釣合いを考えてみれば説明がつきそうである.つまり,2価のバリウム陽イオンがこのようにずれることによってYCuO![]() 層の陽価数の不足分を補っていると考えればよい.したがって,このYCuO
層の陽価数の不足分を補っていると考えればよい.したがって,このYCuO![]() 層は電気的にほぼ中和した,結合力の強い安定な2次元的な層となっており,空洞のまわりのCuO
層は電気的にほぼ中和した,結合力の強い安定な2次元的な層となっており,空洞のまわりのCuO![]() 層とは対照的である.このような構造的な特徴は,化学的な安定性や物理的性質に反映されているはずである.
層とは対照的である.このような構造的な特徴は,化学的な安定性や物理的性質に反映されているはずである.